A Perczel András vezette HUN-REN–ELTE Fehérjemodellező Kutatócsoport munkatársai a fehérjék normális és kóros téralkatának vizsgálata során megfigyelték, hogy az amiloidok nemcsak a neurodegeneratív betegségek kialakulásánál vannak jelen, hanem jótékony élettani folyamatokban, például a vércukorszint szabályozásában is részt vesznek. A felfedezés révén sikerült megérteni, hogy egyes hormonfehérjék esetében melyek azok az egyedi térszerkezeti tulajdonságok, amelyek a környezet függvényében megváltozva befolyásolják szervezetünk egészének folyamatait. Az eredményeket bemutató tanulmány a rangos Nature Communicatons folyóiratban jelent meg.
Idősödő társadalmunkban a neurodegeneratív betegségek kezelése komoly társadalmi és tudományos kihívás, amely az egészségügyi ellátórendszer mellett a kutatás-fejlesztési és innovációs területre is új feladatokat ró. E betegségcsoportra, például az Alzheimer- és a Parkinson-kórra jellemző, hogy egyes fehérjék kóros módon „lerakódnak”, úgynevezett amiloidkötegeket hoznak létre, amelyek egyes sejtek és szövetek ‒ például idegsejtek, a szívizom vagy a tüdő ‒ pusztulását idézik elő. Molekuláris szinten e kóros és esetenként végzetes átalakulások hátterében tehát az amiloidkötegek képződése áll. Ez egyes funkcionális fehérjék valamilyen hatás által kiváltott nem megfelelő feltekeredése, vagyis félretekeredése, amely aztán a nem kívánt összetapadásokhoz, kicsapódáshoz és aggregációhoz vezet. Az amiloidózis és a neurodegeneratív betegségeket kiváltó élettani folyamatok, illetve azok molekuláris háttere azonban a mai napig messze nincsenek felderítve.
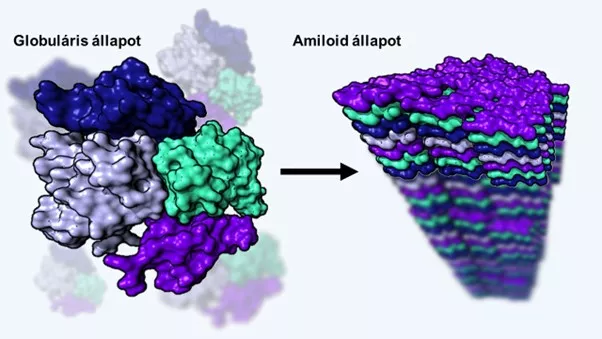
Az emberi transztiretin fehérje funkcionális (baloldali) és kórós (jobboldali) állapota: az utóbbi amiloidforma a szervezet különböző szöveteibe lerakódva vezet egészségkárosodáshoz.
Az amiloid állapot vizsgálata ma is komoly kihívás, amely ugyanakkor nélkülözhetetlen a neurodegeneratív betegségek elleni hatékony gyógyszerfejlesztéshez. A szerkezeti kémikusok és biokémikusok által az ELTE-n is használt modern technikák ‒ többek között a krio-elektronmikroszkópia, a mágneses magrezonancia spektroszkópia (NMR) és a röntgendiffrakció (X-ray) ‒ fejlődésének köszönhetően a kutatók ma már nemcsak a helyesen feltekeredett, hanem a félretekeredett fehérjékről is tudnak atomi felbontású képet alkotni, így kutatni tudják az egészséges és kóros molekuláris kölcsönhatások mibenlétét. A nagy felbontású képalkotás teszi lehetővé, hogy az ELTE Szerkezeti Kémia és Biológia Laboratóriumában – amely 2021-ben bekerült a hazai Top50 infrastruktúrák körébe – megértsék és tudományosan vizsgálni tudják a fehérjék normális és kóros téralkatát.
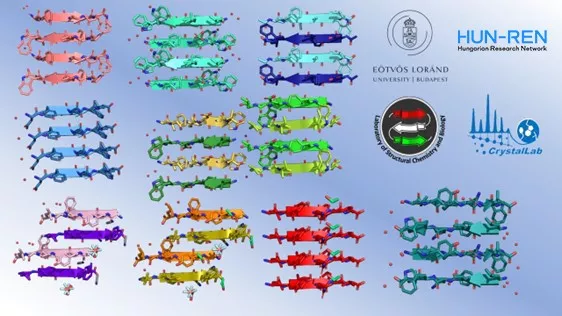
A kutatócsoport munkatársa, Dürvanger Zsolt által röntgenkrisztallográfiai módszerek segítségével meghatározott hormon amiloid-téralkatainak sematikus rajzolata.
Egyes polipeptideknek és fehérjéknek nemcsak az úgynevezett bioaktív globuláris formájuk van jelen a szervezetben, hanem időszakosan rostszerű amiloid formában is léteznek. Ezek a funkcionális amiloidok. Ebben az esetben az amiloid tárolási forma nem társul semmilyen betegséghez, sőt élettanilag fontos szerepet tölt be. Ilyen rövidebb fehérjék például a vércukorszint szabályozásáért és az emésztőrendszer egészségéért felelős egyes hormonok is, például a glükagon vagy a glükagonszerű peptidek (GLP-1 és GLP-2). E hormonok a bioszintézisüket követően pH-függő amiloid formában tárolódnak, majd inger hatására a véráramba kijutva elvesztik amiloid jellegüket, és globuláris formát öltve fejtik ki jótékony élettani hatásukat.
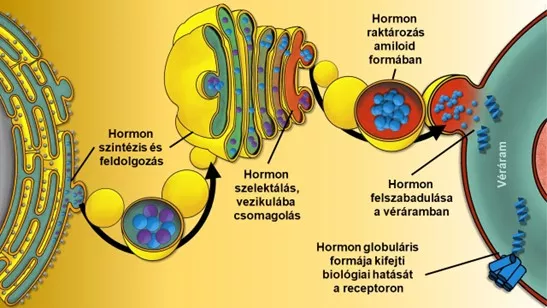
Hormonfehérjék szintézise, feldolgozása, raktározása „jótékony” vagy funkcionális amiloidformában, majd végül az amiloidrostok szétesését követően a célreceptorhoz juttatásuk vázlatos diagramja az első szerző, Horváth Dániel szerint.
A Perczel András vezette HUN-REN‒ELTE Fehérjemodellező Kutatócsoportnak a Nature Communicatonsben publikált legfrissebb kutatási eredményei alapján most sikerült megérteni, hogy e hormonfehérjék mely szerkezeti tulajdonságai teszik lehetővé azt, hogy egyazon fehérje két formában is létezik, azaz amiloid formában van raktározva, majd onnan kiszabadítva egyesével fejti ki hatását a sejtfelszíni receptorokon, és szabályozza szervezetünk egészét.
A kutatás fő célja annak jobb megértése, hogy a fehérjékben mely szerkezeti tényezők miatt alakulhatnak ki az amiloid jellegű fehérjelerakódások. Az eredmények rávilágítanak arra, hogy a receptorkötődésért elsődlegesen a hormonok egy ősi, evolúciósan konzervált aminosavsorrendje ‒ egy minden gerinces fajban azonosan megtalálható molekularészlet ‒ a felelős, amely ugyanakkor a molekulák összeragadását, vagyis amiloidszerű rostokká formálódását is katalizálja. Egyes e szegmensben található aminosavak ‒ a glutaminsav és az aszparaginsav ‒ a környezet savasságának függvényében biztosítják az összetapadást vagy a szétválást. Ez a pH-függő molekuláris váltó vagy kapcsoló teszi lehetővé az amiloid forma fölvételét (összeállás), majd a globuláris forma kialakulását (szétesés vagy monomerizáció) az éppen aktuális kémiai környezettől függően.
A mostani kutatásban is vizsgált glükagonszerű peptidek napjainkban az érdeklődés középpontjába kerültek, ugyanis szintetikus származékaik hatékonyan alkalmazhatók a kettes típusú cukorbetegség kezelésében. Sőt ezek a molekulák az első klinikailag is hatásosnak bizonyuló testtömegcsökkentő gyógyszerek, amelyek jótékonyan hatnak a kardiovaszkuláris rendszerünkre is.
Az eredmények alapján a kutatók azt hangsúlyozzák, hogy az említett, gyógyászati szempontból is jelentős hormonok esetében a jótékony, funkcionális amiloid forma alkalmazása révén lehetővé válik hosszú hatástartamú profillal rendelkező készítmények kifejlesztése, könnyebbé téve a betegek számára az adagolást. E projektek sikere szempontjából is nagy jelentőségű lesz a most épülő, pécsi székhelyű (Pécsi Tudományegyetem) krio-elektronmikroszkópiai centrum, amelynek átadása 2024-2025-ben várható.
Publikáció:
Horváth, D., Dürvanger, Z., K. Menyhárd, D. et al. Polymorphic amyloid nanostructures of hormone peptides involved in glucose homeostasis display reversible amyloid formation. Nat Commun 14, 4621 (2023). DOI: 10.1038/s41467-023-40294-x