A Rho-asszociált protein-kináz 2 (ROCK2) egy több doménből felépülő, sok funkciót ellátó, nagy méretű fehérje, amely több hálózat részeként fontos szerepet játszik számos súlyos betegségben – többek között az Alzheimer- és a Parkinson-kórban, a neurodegenerativ és kardiovaszkuláris zavarokban, valamint a tumorsejtek proliferációjában. Mivel a ROCK-fehérjék számos élettanilag fontos szerepet is ellátnak, kinázaktivitásuk általános kinázgátló szerekkel történő direkt gátlása nem járható út a gyógyszerfejlesztésben. Az ELKH Természettudományi Kutatóközpont kutatói Závodszky Péter professzor vezetésével sikeresen expresszálták ezt a dimert képző, nagy méretű, bonyolult fehérjét. Ez lehetővé teszi egyrészt a membránhoz kötött, hosszú és flexibilis ROCK2-fehérje oldatbeli szerkezetének a meghatározását, másrészt az allosztérikus – azaz csak egy-egy kiválasztott funkciót érintő – kötőhelyek lokalizálását és feltérképezését.
A kutatás egyik fontos eleme a funkcionális partnerfehérjékkel (RhoA, LIM-kináz 1 és 2, miozin-foszfatáz) való kölcsönhatás szerkezeti hátterének a feltárása. A ROCK2-kináz működési mechanizmusával kapcsolatban a direkt adatok hiányában eddig csak hipotetikus szerkezeti modellek álltak rendelkezésre. A kutatók mostani munkája megmutatta, hogy a ROCK2 valójában oldatban nyújtott, illetve részlegesen feltekeredett konformációk dinamikus egyensúlyban lévő keveréke. Ez a felismerés immár szerkezeti magyarázatot ad a membránhoz közeli és a membrántól távoli funkciók közötti váltás mechanizmusára. Nyugalmi állapotban a ROCK2 az N-terminális kináz domén és a C-terminális ciszteingazdag régiók intramolekuláris kölcsönhatása révén gátolt állapotban van. A dinamikus modell szerkezeti szempontból értelmezhetővé teszi ezt az állapotot, a szubsztrátfehérjékkel (RhoA) végzett kísérletek pedig magyarázatot adnak a gátlás feloldásának a mechanizmusára.
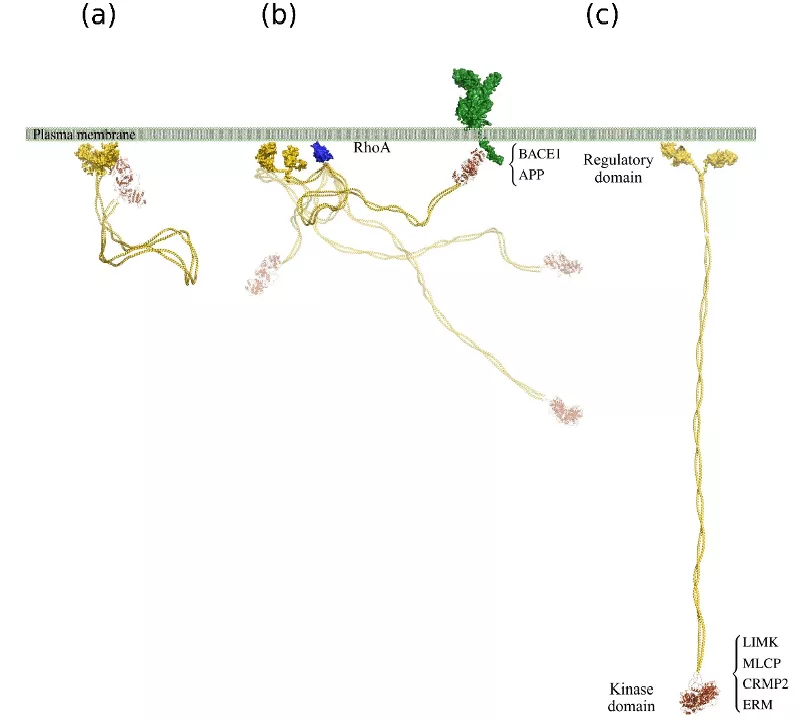
A membránhoz kapcsolódó ROCK2 – a C-terminális szabályozó és az N-terminális kináz doménjei közötti kölcsönhatás révén – nyugalmi állapotban laza, kompakt konformációban van (a). A RhoA szabályozó fehérje kötődése a kompakt szerkezet fellazulását okozza, így az N-terminális domén eltávolodik a C-terminustól (b), lehetővé téve ezzel a membrántól távoli szubsztrátokkal való kapcsolódást, és a nyújtott állapot stabilizálását (c)
A Nature Communications Biology című folyóiratában a közelmúltban publikált eredmények a ROCK2 működésének számos elemére adnak tehát szerkezeti magyarázatot. A kutatás jelentőségét emellett az adja, hogy az új eredmények alapján folytatódhat az a gyógyszerfejlesztés szempontjából ígéretes munka, amely a ROCK2 funkcionális partnermolekulákkal való kapcsolódást szolgáló kötőfelszíneinek lokalizálására és ezek atomi szintű feltérképezésére irányul. E kötőfelszínek szerkezetének és töltéseloszlásának ismerete módot ad szelektív, kis molekulatömegű gátlószerek tervezésére, illetve a hatásuk ellenőrzésére. Ez azért fontos, mert lehetővé teszi, hogy a mellékhatások miatt kerülendő, általános kinázgátló szerek helyett olyan allosztérikus gyógyszereket tervezzenek a kutatók, amelyek csak a betegség szempontjából releváns fehérje–fehérje kölcsönhatásokra irányulnak. A munka két nyomon is folytatódik: egyrészt az Alzheimer-kórban releváns, membránhoz közeli kölcsönhatások feltérképezésének és ezek gátlásának, másrészt pedig a membrántól távoli, tumorproliferációval kapcsolatos funkciók vizsgálatának irányában. A kutatócsoport számára a közelmúltban odaítélt OTKA-támogatás nagy segítséget nyújt a munka folytatásához.