Ahogy az ékezetek a betűkön fontosak lehetnek egy szöveg megértéséhez, a nukleinsavak különböző módosulásai is jelentős szerepet játszanak a genetikai információ dekódolásában. A DNS epigenetikai, vagyis a genetikai szekvenciát nem érintő módosulásainak szerepe évtizedek óta széleskörűen tanulmányozott területnek számít, ugyanakkor az elmúlt évek rávilágítottak arra, hogy az RNS-nek is számos hasonló, úgynevezett epitranszkriptomikus módosulása szintén fontos biológiai szerepet tölt be. Az ELKH Természettudományi Kutatóközpont (TTK), az Eötvös Loránd Tudományegyetem (ELTE), a Budapesti Műszaki és Gazdaságtudományi Egyetem (BME) és a Semmelweis Egyetem (SE) kutatói a szakterület egyik vezető lapjában, az ACS Catalysisben a közelmúltban publikált tanulmányukban egy ilyen RNS-módosító mechanizmus részleteit ismertették. A kutatók rámutattak, hogy bár a mechanizmus sérülése genetikai betegségekhez vezethet, pontosabb megértése terápiás lehetőséget is rejt.
Az uridin pszeudouridinné való átalakulása az RNS leggyakoribb módosulása a DNS-ről való átíródás után. A reakciót egy nagy méretű fehérje-RNS komplex, a box H/ACA pszeudouridin szintáz katalizálja. A komplex fehérjealkotóinak mutációja daganatos betegségek, csontvelőhiány és nefrotikus szindróma kialakulását okozhatja.
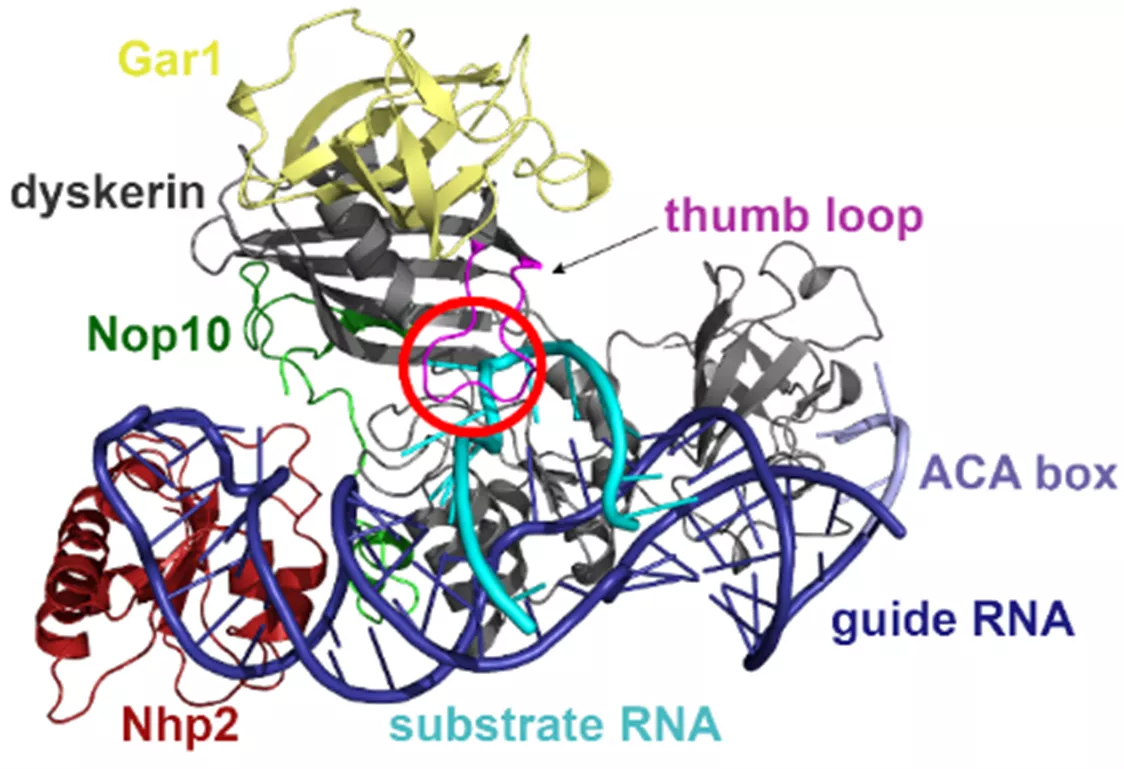
A kutatók felépítették a pszeudouridin szintáz komplex modelljét. Nagy számítógép-teljesítményt igénylő szimulációk segítségével azonosították az atomok helyzetének és kölcsönhatásainak változását, emellett a kémiai kötések átalakulásának mechanizmusát is feltárták az uridin pszeudouridinné való transzformációja során. Azt találták, hogy az átalakítandó RNS olyan torzult formában kötődik a box H/ACA pszeudouridin szintázhoz, amely megkönnyíti a kötődést követő uridin-pszeudouridin átalakítást. Azt is megmutatták, hogy az enzim mutáns variánsai nem torzítják a megkötött RNS uracilját, ami összhangban van ezen mutánsok kísérletileg észlelt inaktivitásával.
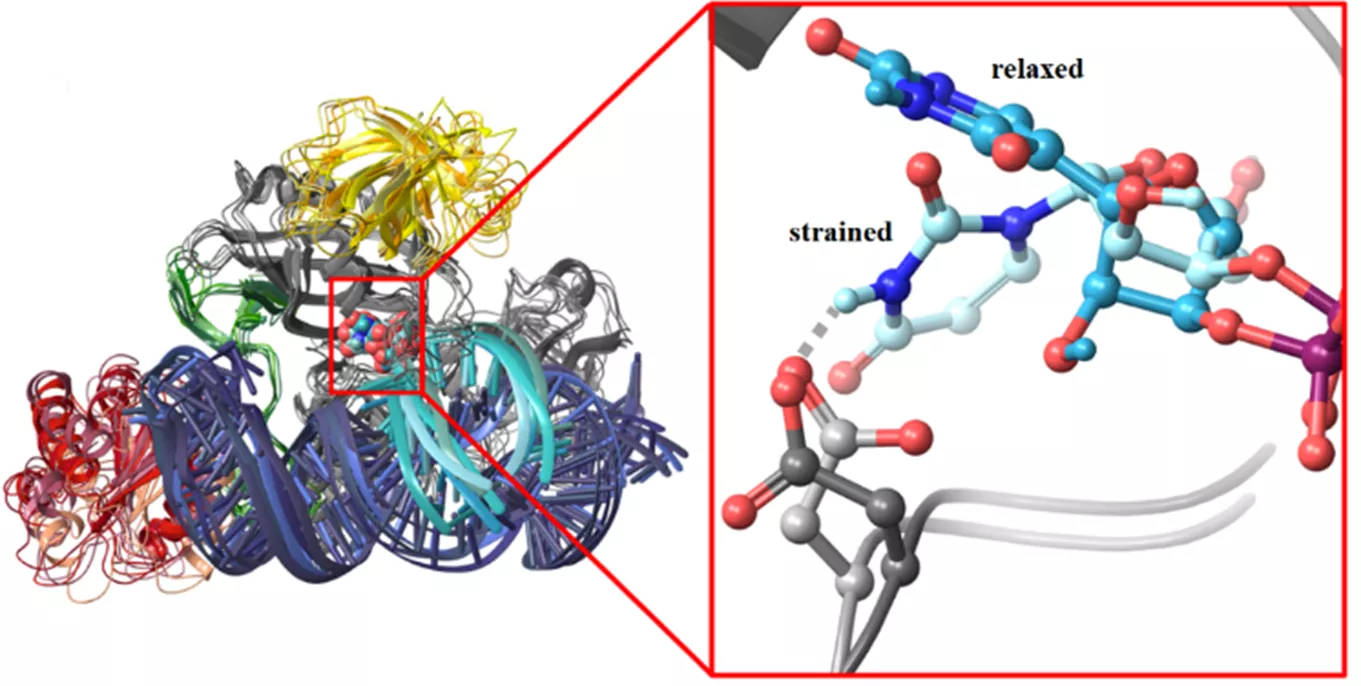
A kutatók rámutattak, hogy az azonosított mechanizmus lehetővé teszi az uracil átalakítását bármely olyan tetszőleges RNS-ben, amely képes megfelelően kötődni a box H/ACA pszeudouridin szintáz vezérlő RNS-éhez, továbbá hogy a vezérlő RNS szerkezete nagymértékben változtatható. Ilyen módon a box H/ACA pszeudouridin szintázhoz kötött, alkalmasan tervezett vezérlő RNS szinte bármely tetszőleges RNS szubsztrát uraciljának átalakítását képes elvégezni a szervezeten belül. Ez a szakemberek számára lehetőséget teremt az RNS szerkesztésére és génhibákhoz kötődő betegségek gyógyítására.
A K111862, K116305 és FK124230 számú projektek az Innovációs és Technológiai Minisztérium Nemzeti Kutatási, Fejlesztési és Innovációs Alapból nyújtott támogatásával, az OTKA pályázati program finanszírozásában valósultak meg. A kutatáshoz szükséges számítási kapacitást a Kormányzati Informatikai Fejlesztési Ügynökség (KIFÜ) HPC infrastruktúrája biztosította.
Publikáció:
Kiss, D. J., Oláh, J., Tóth, G., Varga, M., Stirling, A., Menyhárd, D. K. & Ferenczy, Gy. G. (2022). The structure-derived mechanism of box H/ACA pseudouridine synthase offers a plausible paradigm for programmable RNA editing. ACS Catalysis, Doi: https://doi.org/10.1021/acscatal.1c04870